Открытие нейтрона дало толчок к пониманию того, как устроены ядра атомов.
В том же 1932 г., когда был открыт нейтрон, советским физиком Дмитрием Дмитриевичем Иваненко и немецким физиком Вернером Гейзенбергом была предложена протонно-нейтронная модель строения ядер, справедливость которой была впоследствии подтверждена экспериментально.
Протоны и нейтроны называются нуклонами (от латинского nucleus — ядро). Используя этот термин, можно сказать, что атомные ядра состоят из нуклонов.
Общее число нуклонов в ядре называется массовым числом и обозначается буквой А.
Массовое число ставится вверху перед буквенным обозначением химического элемента. Так, например, для азота массовое число А = 14, для железа А = 56, для урана А = 235.
Понятно, что массовое число А (т.е. общее число нуклонов в ядре) численно равно массе ядра m, выраженной в атомных единицах массы и округленной до целых чисел (поскольку масса каждого нуклона примерно равна 1 а. е. м.).
Например, для азота А = 14, m ~ 14 а. е. м., для железа А = 56, m ~ 56 а. е. м. и т. д.
Число протонов в ядре называется зарядовым числом и обозначается буквой Z.
Например, для азота Z = 7, для железа Z = 26, для урана Z = 92 и т. д. Как видно из приведенных примеров, зарядовое число ставится внизу перед буквенным обозначением элемента.
Заряд каждого протона равен элементарному электрическому заряду. Поэтому зарядовое число Z (т. е. число протонов в ядре) численно равно заряду ядра, выраженному в элементарных электрических зарядах. Для каждого химического элемента, зарядовое число равно атомному (порядковому) номеру в таблице Д. И. Менделеева.
Ядро любого химического элемента в общем виде обозначается
так:![]() (под X подразумевается символ химического элемента).
(под X подразумевается символ химического элемента).
Число нейтронов в ядре обычно обозначают буквой N (не путайте с химическим символом азота). Поскольку массовое число А представляет собой общее число протонов и нейтронов в ядре, то можно записать: А = Z + N.
На основе протонно-нейтронной модели строения атомных ядер было дано объяснение интересным экспериментальным фактам, открытым в первые два десятилетия XX в.
Так, в ходе изучения свойств радиоактивных элементов было обнаружено, что у одного и того же химического элемента встречаются атомы с различными по массе ядрами.
Одинаковый заряд ядер свидетельствует о том, что они имеют один и тот же порядковый номер в таблице Д. И. Менделеева, т. е. занимают в таблице одну и ту же клетку, одно и то же место. Отсюда и произошло название всех разновидностей одного химического элемента: изотопы (от греческих слов isos — одинаковый и topos — место).
Изотопы — это разновидности данного химического элемента, различающиеся по массе атомных ядер.
Благодаря созданию протонно-нейтронной модели ядра (т. е. примерно через два десятилетия после открытия изотопов), удалось объяснить, почему атомные ядра с одним и тем же зарядом обладают разными массами. Очевидно, ядра атомов изотопов содержат одинаковое число протонов, но различное число нейтронов.
Так, например, существует три изотопа водорода: протий, дейтерий и тритий. Ядро изотопа водорода - протия - вообще не имеет нейтронов — оно представляет собой один протон. В состав ядра дейтерия входят две частицы: протон и нейтрон. Ядро трития состоит из трех частиц: одного протона и двух нейтронов.
1. Как называются протоны и нейтроны вместе?
2. Что называется массовым числом и какой буквой оно обозначается?
3. Что можно сказать о числовом значении массы атома (в а. е. м.) и его массовом числе?
4. Как называется и какой буквой обозначается число протонов в ядре?
5. Что можно сказать о зарядовом числе, заряде ядра {выраженном в элементарных электрических зарядах) и порядковом номере в таблице Д. И. Менделеева для любого химического элемента?
6. Как в общем виде принято обозначать ядро любого химического элемента?
7. Какой буквой обозначают число нейтронов в ядре?
8. Какой формулой связаны между собой массовое число, зарядовое число и число нейтронов в ядре?
9. Как с точки зрения протонно-нейтронной модели ядра объясняется существование ядер с одинаковыми зарядами и различными массами?
1. Сколько нуклонов в ядре атома бериллия
![]() ? Сколько в нем протонов? нейтронов?
? Сколько в нем протонов? нейтронов?
2. Для атома калия
![]() определите: а) зарядовое число; б) число
протонов; в) заряд ядра (в элементарных электрических зарядах); г) число электронов; д) порядковый номер в таблице Д. И. Менделеева; е) массовое число ядра; ж) число нуклонов; з) число нейтронов; и) массу ядра (в а. е. м. с точностью до целых чисел).
определите: а) зарядовое число; б) число
протонов; в) заряд ядра (в элементарных электрических зарядах); г) число электронов; д) порядковый номер в таблице Д. И. Менделеева; е) массовое число ядра; ж) число нуклонов; з) число нейтронов; и) массу ядра (в а. е. м. с точностью до целых чисел).
3. Определите с помощью таблицы Д. И. Менделеева, атом какого химического элемента имеет: а) 3 протона в ядре; б) 9 электронов.
4. При
a-распаде исходное ядро, излучая
a-частицу, превращается в ядро атома другого химического элемента.
Например,
![]()
На сколько клеток и в какую сторону (к началу или к концу таблицы Д. И. Менделеева) смещен образовавшийся элемент по отношению к исходному?
Перепишите в тетрадь данное ниже правило смещения для a-распада, заполнив пропуски:
при a-распаде одного химического элемента образуется другой элемент, который расположен в таблице Д. И. Менделеева на ... клетки ближе к ее ..., чем исходный.
5. При b-распаде исходного ядра один из входящих в это ядро нейтронов превращается в протон, электрон и антинейтрино (частицу, легко проходящую сквозь земной шар и, возможно, не имеющую массы). Электрон и антинейтрино вылетают из ядра, а протон остается в ядре, увеличивая его заряд на единицу. Например,
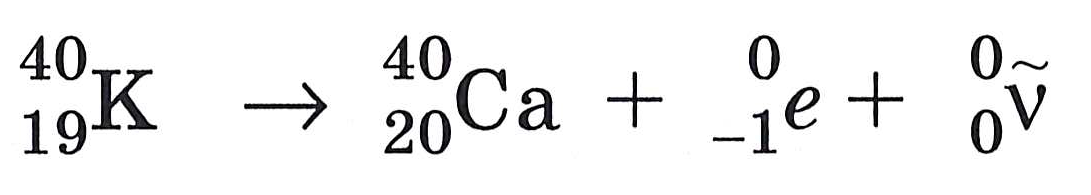
Перепишите данное ниже правило смещения для b-распада, заполнив пропуски нужными словами:
при b-распаде одного химического элемента образуется другой элемент, который расположен в таблице Д. И. Менделеева на ... клетку ближе к ... таблицы, чем исходный.